◆トップページに移動 │ ★目次のページに移動 │ ※文字列検索は Ctrl+Fキー
鉛、その合金又は化合物(四アルキル鉛を除く。)による疾病の認定基準について
昭和46年7月28日基発第550号
(各都道府県労働基準局長あて労働省労働基準局長通知)
標記の認定基準について、自今、下記のとおり改めることとしたので、その取扱いに遺憾のないようせられたい。
なお、本通達の施行に伴い、従来の標記認定基準に関する通達はこれを廃止する。
おつて、個々の事案について、本通達の基準により難いか、もしくは判断が著しく困難な場合には、具体的資料を添えて本省にりん伺されたい。
記
鉛、その合金または化合物(四アルキル鉛を除く。)を取り扱い、あるいはそれらのガス、蒸気もしくは粉じんにさらされる業務に従事しているかまたはその業務に従事していた労働者が、次の各項の何れかに該当する場合には、労働基準法施行規則別表第1の2第4号の規定に基づく労働省告示第36号表中に掲げる鉛及びその化合物による疾病として取り扱うこと。
1.次の各号に該当するものであること。ただし、(2)または(3)の何れかが基準値に満たない場合には、当分の間本省にりん伺すること。
(1) 鉛中毒を疑わしめる末梢神経障害、関節痛、筋肉痛、腹部の疝痛、便秘、腹部不快感、食欲不振、易労感、倦怠感、睡眠障害、焦燥感、蒼白等の症状が2種以上認められること。
(2) 尿1リットル中に、コプロポルフィリンが150マイクログラム以上検出されるかまたは尿1リットル中にデルタアミノレブリン酸が6ミリグラム以上検出されるものであること。
(3) 血液1デシリットル中に、鉛が60マイクログラム以上検出されるかまたは尿1リットル中に、鉛が150マイクログラム以上検出されるものであること。
2.次の各号に該当するものであること。
(1) 血色素量が、血液1デシリットルについて常時男子12.5グラム、女子11.0グラム未満であるかもしくは全血比重が男子1.053、女子1.050未満であるか、または赤血球数が血液1立方ミリメートル中、常時男子420万個、女了370万個未満であって、これらの貧血徴候の原因が、消化管潰瘍、痔核等の事由によるものでないこと。
なお、常時とは、日を改めて数日以内に2回以上測定した値に大きな差を認めないものをいう。ただし、赤血球については、同時に貧血に関する他の数項目を測定した場合、それらに一定の傾向があった時はこの限りでない。
また、採血は空腹時に行なうものとする。
(2) 1週間の前と後の2回にわたり尿1リットル中にコプロポルフィリンが150マイクログラム以上検出されるかまたは、尿1リットル中にデルタアミノレブリン酸が6ミリグラム以上検出されるものであること。
3 鉛の作用によることの明らかな伸筋麻ひが認められるものであること。
(解説)
1.本通達(以下「新通達」という。)は、従来の通達(昭和25年6月27日付基発第605号、昭和34年10月8日付基発第693号、昭和39年9月8日付基発第1049号)による鉛中毒に関する認定基準を改めたものである。すなわち、旧通達を策定した当時においては、いわゆる鉛中毒症等に関する診断方法、検査方法等が未だ開発途上にあったために、自他覚症状等当時まで慣用されてきた臨床手法にもとづいて認定基準を定めたものであるが、現在はこれらに関する診断並びに検査方法等が著しく進歩してきたので、それらの新らしい検査方法等を加え、具体的事案の認定事務を公正、かつ、容易に行なえるよう配慮し、改正したものである。
2.
イ 新通達では、記の1の(2)及び2の(2)に、尿中のコプロポルフィリンの量を示してあるが、これは、判断基準を明確にするため、定量法によることを明らかにしたものである。
ロ 尿中のコプロポルフィリンの測定法については、原則として別紙(1)の検査方法によることとし、これにより検出された数値により判断すること。
3.
イ 新通達では、記の1の(2)及び2の(2)に、尿中のデルタアミノレブリン酸の量を示してあるが、これは現在鉛中毒の診断上有効な検査方法であると認められることから、新しく採用したものである。
ロ 尿中のデルタアミノレブリン酸の測定法については、原則として別紙(2)の検査方法によることとし、これにより検出された数値により判断すること。
4.新通達の記の1の(3)の血中または尿中の鉛量の測定については、原則として別紙(3)の検査方法によることとし、これにより検出された数値により判断すること。
5.新通達の記の1及び2に示した検査の結果による数値は、いわゆる誘発法(Provocation testまたはMobillization test)を行った後の、測定値ではない。
なお、鉛中毒の診断に当り、症例によってはいわゆる誘発法が行なわれる場合があるが、これが取扱いについては、当面別紙(4)によること。
6.新通達に示した尿中コプロポルフィリン、尿中デルタアミノレブリン酸、血中鉛、尿中鉛に関する数値は、一般的には、これらの数値を超えた場合に、鉛中毒を疑わしめるものとして例示した症状のうちの軽微なものが発現することもあると考えられているものであるが、鉛中毒症の早期発見、早期治療を期する上から今回、これらの数値を採用したものである。
しかしながら、貧血、尿中コプロポルフィリン、尿中デルタアミノレブリン酸は、他の原因によっても、新通達の数値を超える場合もあるので、とくに、新通達の記の2の適用に当っては、他の疾病との鑑別診断の結果を検討の上、認定するよう留意すること。
別紙(1)
尿中のコプロポルフイリンの検査方法
1 原理
尿中コプロホルフイリン及びコプロポルフイリノーゲンは酢酸を含むエーテル層に最初にうつし、水洗後ヨードで酸化して、コプロポルフイリンを塩酸で抽出した後、再びpH3.5としてこれをエーテル層にうつし、1N塩酸で抽出して吸光度を計測する。
2 器具と試薬
(1) 器具
イ 分液ロートロ(300ml)
ロ 分光光度計
ハ 蒸留装置
ニ 目盛付共栓試験管(10ml)(検定済)
(2) 試薬
イ 精製エーテル(試薬特級)
過酸化物をふくむときは、エーテル4lにFeSO4・7H2O 40g 1N・NaOH20mlを加えて蒸留し、えられた精製エーテルは冷暗所にたくわえる。
ロ 氷酢酸(試薬特級)
ハ 塩酸
1.5N塩酸(試薬特級塩酸133mlを留水でうすめて1lとする)及び1N塩酸
ニ ヨード液
Stockとして1gのヨードを100mlの精製エタノールに溶かし、留水でうすめて全量を200mlとする。冷蔵庫内に褐色瓶にいれて貯える。
使用に際して、これを精水で0.005%ヨード液とする。
ホ 飽和酢酸ソーダ液
ヘ 食塩
ト 精製エタノール
チ 蒸留水
3 測定法
分液ロート(約300ml)に新鮮尿を25mlとり、これに氷酢酸2.5mlを加える。(注1)ついで精製エーテル50mlを加え、30秒間よく振とうして放置する。水層を分離し、精製エーテル25mlで再抽出する。次に蒸留水で2~3回軽く静かにエーテル層を洗う。水層を捨てる。あまり強く振ると、コプロポルフイリンが水層にうつるおそれがある。
残つたエーテル層に0.005%ヨード液5~10mlを加え、コプロポルフイリノーゲシをコプロポルフイリンに酸化する。
最後に1N塩酸で、5ml、2ml、2mlずつ3回エーテル層のコプロポルフイリンを抽出し、目盛付共栓試験管にうつし、精製アルコールで10mlとし、混和して1cmの厚さのセルを用いて、光度計380mμ、401mμ、430mμの吸光度をしらべ、次式によつて計算する。
{2×OD401-(OD430+OD380)}×837×v/V=μg・コプロポルフイリン/l
(V=尿量、v=抽出塩酸量)
〔注〕
(1) 稀薄なポルフイリン液は、pH3.5で最もよくエーテルにうつる。移りにくい場合は必ず水層のpHをしらべなくてはならない。pH3.5でも移らないときは、尿中にウロポルフイリンが存在している可能性がある。
(2) エムルジオンになつて2層の分離が悪いときは、更に精製エーテルを加え、食塩又は精製エタノールを加えるとエムルジオンはたいてい消失する。
どうしてもエムルジオンが消失しないときは、遠心分離して上澄液を用いる。
(3) 分光光度計によつて、コプロポルフイリンの吸光度が異なることがあるので、分光光度計をチエツクすることが必要である。
(4) コプロポルフイリンⅢ、テトラメチルエステルが市販されている。これを用いて標準液を作成する場合には、分解が起つている場合があるので、それを確認し、必要ならば精製しなければならない。
別紙(2)
尿中デルタアミノレブリン酸測定法
浦田グラニツク法(J.Biol chem,Vol 238.PP811.1963)
1 原理
2種類のイオン交換樹脂を用いて、δ―ALAを分離し、ALAピロールをつくり、これをエールリツヒ試薬によつて赤色に発色させ、比色定量する。
2 器具
カラム (3) 内径9mm前後 長さ30cm
但し、3本のうち1本の長さ10cmのものでよい。
比色計 (1) 552mμ
フイルター式の場合はその近くのフイルターを用いる。
その他、試験管、pHメーター又はpH試験紙、三角フラスコ、コガラス棒、ピペツト類、煮沸用湯浴器、ロート、脱脂綿、純水( )内は1検体当りの本数
3 試薬(後記「参考」参照)
○ 陽イオン交換樹脂 100~200メツシユ
○ 陰イオン交換樹脂(強塩基性) 200~400メツシユ
○ メタノール(特)
○ 氷酢酸
○ 酢酸ソーダ(特)
○ アセチルアセトン
○ 塩酸
○ 水酸化ナトリウム
○ 塩化第2水銀(特)
○ 過塩素酸(特)
○ パラジメチルアミノベンズアルデヒト(特)
4 試薬の調製
(1) 樹脂の調製 陽イオン交換樹脂について
1検体7ml程度必要
三角フラスコに必要量をとり、純水を10~20倍量加えて振る、放置、上清をすてる。
以上を上清が清澄になるまで(3~4回)くり返す。上清を捨て、1N・NaOHを樹脂の10倍量加えて混合、1晩放置。
上清を捨て、樹脂の10~20倍量の純水で10回ほど洗滌をくり返すと、pHがアルカリ性でなくなる。
1N・HClで2回洗う。
HClがなくなるまで、水で洗う。約10回
酢酸緩衡液(pH4.8)を入れておく。
(2) 樹脂の調製 陰イオン交換樹脂(強塩基性)について
1検体5ml程度必要
(1)のように、水で洗い、ゴミなど除く。
3N、酢酸ソーダを樹脂の10倍量加え、これで3回洗う。もう1度これを加え、1晩放置アルカリ性でなくなるまで水で洗う。
酢酸ソーダは特級のものでも、クロールイオンclを多量に含むものがあるので事前に硝酸銀でチエツクするとよい。
以上の調製法は、パツチ法である。原法はカラムを用いているが、これだと時間がかかる。
(3) 酢酸バツフアー(pH4.6)1M
氷酢酸57ml水を加えて1lにする。
酢酸ソーダ136g水を加えて1lにする。
pH4.8の酢酸バツフアーは、それぞれ、45mlと100gを加え水で1lにする。
(4) エールリツヒ試薬
以下のものを、その都度つくる、5ml/検体必要
パラジメチールアミノベンズアルデヒト 4g
氷酢酸 168ml
過塩素酸 40ml
塩化第2水銀 0.7g
以上の混合物に、水を加えて全量220mlとする。
(5) メタノール酢酸混合物
容量で2:1に混合
(6) 1M酢酸
5 カラムと尿の調製
(1) カラムの調製
第1カラム 調製した陰イオン交換樹脂
第2カラム 調製した陽イオン交換樹脂
第3カラム 調製した陰イオン交換樹脂
1検体につき3本のカラムをスタンドに垂直にたて、綿栓をつめ、水を流す。
駒込ピペツトで、上記樹脂を均一につめていく。
第1.2.3カラム、それぞれ3.7.1cmの高さまでつめる。
つめたら、その上に綿栓をおく。(図)
(2) 尿の調製
普通の人の尿で3.0ml、鉛作業者ではALAの排泄量によるが、その1/2~1/3量を試験管にとり、pHを5%酢酸で5~6に調節する。
6 操作
(1) 検体を完全に第1カラムに流し込む。流出液を下で試験管に受ける。
(2) 流下終了後、純水6mlを同一カラムに流し、(1)の試験管に受ける。
(3) (1)と(2)とを併せたもの(流出液)を第2カラムに流し込む。流出液を下で試験管(20~30ml)に受ける。
(4) 流下終了後、純水10mlをこのカラムに流し洗う。
洗液は一緒にする。
(5) (4)の流出液に、酢酸バツフア1mlとアセチルアセトン0.5mlを加え、よく混合
(6) 沸澄水溶中に10分間浸し、煮沸する。
(7) 放冷後、第3カラムに流す。流出液はすててよい。
ALAピロールはここに沸縮補捉される。
(8) 1M酢酸5mlをこのカラムに流して洗う。流出液はすてる。
(9) 10ml目盛付試験管をカラムの下に置き、カラムにメタノール酢酸4mlを流し、ALAピロールを流出せしめる。
(10) 5mlの目盛までメタノール酢酸を加える。
(11) エールリツヒ試薬5.0mlを加え、混合。
(12) 混合後15分で比色 552mμ
7 標準線の作成
原法は、Molar absorbancy 5.3×104として、計算している。
ALAは容易に手に入るので、これを購入して、自ら検量線を作つてもよい。その場合は次のようにする。
(1) ALA標品
ALA・HCl 分子量 167.6
ALA 分子量 131.1
(ALA塩酸塩結晶100mgがアンプル入りで売り出されている。)
(2) 適用量のALA・HClを化学天秤で正確に秤りとり、水を加え、pHを5~6に調節、更に水を加えて、ALAとして、10mg/lの標準液をつくる。
(3) これを稀釈して、1.2.3.5mg/lの濃度階段の標準液稀釈系列をつくつて、尿と同様の操作で分離、比色する。
注:尿ALAの測定には、各種の簡便法が工夫されている。これらの簡便法を用いる場合には本法に対して比較、較正するこよが必要である。なお、一般には、別添の測定法(Mauzcrall―Granick法)も普及しているので、これによる場合も差し支えないこと。
参考:試薬中の陽イオン交換樹脂及び陰イオン交換樹脂については、浦田グラニシク法の場合、次のものが用いられている。
陽イオン交換樹脂……アンバーライトIRC50
陰イオン交換樹脂……ダウエツクス1×8
(別紙(2) 別添)
尿中デルタアミノレブリン酸測定法
原理
δ―ALAはアセチルアセトンとの縮合によりピロールを作る。ピロールはエールリツヒ試薬のPジメチルアミノベンツアルデヒドと酸性溶液で赤色化合物を形成する。エールリツヒ試薬による反応に影響を及ぼす尿中の還元物質はあらかじめカラムにより分離を行う。
試薬および器具(後記「参考」参照)
1 陰イオン交換樹脂 200―400メツシユ
陽イオン交換樹脂 200―400メツシユ
2 4N、2N、1N―塩酸溶液
3 3M、0.5M―酢酸ソーダ溶液
4 1M―酢酸溶液
5 アセチルアセトン
6 酢酸緩衡液(pH4.6)
酢酸ソーダNaCH3CO23H2Oの136gに氷酢酸57mlを加え、蒸留水で1lとする。
7 エールリツヒ試薬
P―ジメチルアミノベンツアルデヒド1gを約30mlの氷酢酸にとかし、過塩素酸HClO4(70%)、8.0mlを加える。その後氷酢酸で50mlとする。この試薬は使用の都度作成する。
8 カラム(内径10mmと8mmの2種類)
9 ウオーターバス
10 分光光電光度計
定量操作法
1 前処理
陰イオン交換樹脂は水洗後3Mの酢酸ソーダ溶液でクロライドフリーになる迄洗い、次に酢酸ソーダがフリーになるまて蒸留水で洗滌する。
陽イオン交換樹脂は水洗後2N―可性ソーダで一夜放置し、蒸留水で中性になる迄洗滌する。
2 定量操作
第1カラム(内径10mm)、第2カラム(内径8mm)のそれぞれの底部に樹脂の流出を防ぐためグラスウールを2~3mmつめる。
第1カラムには蒸留水に浮かした陰イオン交換樹脂を駒込ピペツトで3ml入れる。
第2カラムには陽イオン交換樹脂を同様に入れ、1.5cmくらいの高さとする。それぞれ蒸留水を通す。流速は3ml/10minとする。第2カラムには4N―塩酸1ml 1回、2N―塩酸5ml 1回、1N―塩酸5ml 1回を通す。蒸留水で中性になるまで洗滌する。
1) 第1カラムに尿1mlをホールピペツトで加え、次に蒸留水を2mlずつ5回加える。
2) 滴下液約11mlを第2カラムに加える。蒸留水で洗滌する。この滴下液はすてる。
3) 0.5M酢酸ソーダ溶液2mlずつ4回加え、この滴下液は試験管にとる。
4) アセチルアセトン0.2mlを加え、pH4.6の酢酸緩衡液で10mlとする。
5) 100°Cの水溶中で10分間加熱。
6) 放冷後この溶液2mlをとり、エールリツヒ試薬2mlを加え、15分後に553mμで比色する。
3 カラムの再生
第1カラムに1M―酢酸2ml、0.2M―酢酸2mlで2回洗い、蒸留水で中性になるまで洗滌する。
第2カラムは蒸留水で中性になるまで洗滌する。
計算
吸光度×47=mg/l
参考:試薬中の陰イオン交換樹脂及び陽イオン交換樹脂については、Mauzerall―Granick法の場合次のものが用いられている。
陰イオン交換樹脂……ダウエツクス2×8
陽イオン交換樹脂……ダウエツクス50×8
別紙(3)
血中および尿中の鉛の検査方法
1 目的と原理
鉛業務従事作業者にみられる血中および尿中の鉛量の増加の程度を測定することにより、鉛への暴露の程度ないしは鉛中毒罹患の有無を判定する資料とする。
ジチゾン(diphenylthiocarbazone:Dzと略す)液はクエン酸を含むpH9―12の弱アルカリ溶液中で鉛イオンと、錯塩を作り、有機溶媒に抽出されて特有の呈色を示す。これを比色定量とする。
2 器具と試薬
(1) 器具
イ 採血用具一式
ロ 注射筒(20ml)
ハ 注射針(1/1)
ニ 採尿容器(ポリエチレン広口1,000ml以上)
ホ 石英容器(ビーカー200ml以上):乾式灰化用
ヘ 電気炉
ト ケルダールフラスコ(200ml以上):湿式灰化用
チ ろ過器(石綿又はガラス)
リ 電熱板又は赤外線ランプ
ヌ 分液ロート(100~300ml数回及び1l)
ル 目盛付共栓付試験管(20ml):検定済
ヲ 分光光度計又は510~520mμのフイルターを有する光電比色計
ワ 乳鉢、ろ紙、水浴、蒸留器
塩ビ製品は鉛の溶出が多いのでつかわないこと。
〔器具の清浄法〕
注射筒及び鉛を含まないガラス、及び石英の器具は最初クロム硫酸に浸漬したのち、水洗し、次いで5%硝酸で約10分間煮沸したのち精水で十分洗浄し、乾燥して使用する。注射針は1%硝酸、次いで精水をよく通して洗い、精水で10分間煮沸乾燥する。採尿容器は30%硝酸であらかじめよく除鉛しておき、精水で洗浄乾燥させる。
なお、塩ビ製品は鉛の溶出が多いので用いない。
(2) 試薬
除鉛操作をするものでもなるべく試薬特級を用いる。クロロホルムは試薬1級を精製する。ジチゾン試薬特級(重金属鉛として0.002%以下)を使用する。
イ 再蒸留水又は純水(以下精水と記す)
ロ 硫酸塩酸、硝酸、過塩素酸、アンモニア水(いずれも鉛定量用又は試薬特級)
ハ クエン酸アンモニウム溶液(40%)
クエン酸400gを乳鉢で粉砕し、少量の水で溶解後0.04%チモールブルー溶液数滴を加え、撹伴しながらアンモニア水(約30%)を発熱がひどくならないように少量ずつ混じてpH8.5~9.0(淡青色)とし、無灰ろ紙で試薬中のゴミを除き、分液ロートにうつす。
次にこれにDz(除鉛用)液約50mlを加え、よく振とうし、Dz層を分別して捨てる。加えたDz液が振とう後も原色のままで残るまで振とう分別をくりかえす。
ついで精製クロロホルム(後記)を約10ml加え、クエン酸アンモニウム溶液中に残留したDzを振とう抽出して分別する。加えたクロロホルムが振とう後も着色しなくなるまでくり返す。最後に精水を加えて1lとする。これは冷暗所に保存する。
ニ 塩酸ヒドロキシルアミン溶液(20%)
粉末20gを分液ロートにとり、水6.5ml、を加えて溶解し、0.04%チモールブルー溶液数滴を加え黄色を呈するまでアンモニア水を加える。次に5%ジエチルジオカルバミン酸ナトリウム水溶液2mlを加えて振とうし、更に精製クロロホルム約5mlを加えて振とうし、(静置後)褐色の下層液を分別して捨てる。分別したクロロホルム(下層)に約0.5%の割合になるように硫酸銅水溶液を加えて振とうしても、クロロホルムが黄色を呈しなくなるまで精製クロロホルムによる洗滌分別をくりかえす。分液ロート中の残液に塩酸を加え、淡ピンク色を呈したものに精水を加えて100mlとする。
ホ シアン化カリウム溶液
シアン化カリウムと精水で50g/dl水溶液をつくり、無灰ろ紙でろ過したのち分液ロートに移す。ハと同様の除鉛操作を(72時間以内に)行なつたのち精水を加えて1lとする。冷暗所に保存する。
ヘ 稀シアン化カリウム液:1%KCN100ml+アンモニア水1ml
ト シアン化カリウム、アンモニア水混合液
精製した50%シアン化カリウム液40mlにアンモニア水150mlを混ぜ、水を加えて1lとする。冷暗所に保存する。
チ 精製クロロホルム
クロロホルムを蒸留用フラスコにうつし、少量のCaCl2を加え、24時間静置後、さらに精製エタノールを1/100容追加し、水浴上で加温蒸留し、60°C~61°Cの分留水をあらかじめ精製エタノール少量(分留クロロホルムの1/100容)を入れた瓶中に受ける。冷暗所に保存する。以上の操作のほかに1%塩酸で洗い、更に水洗すれば使用に耐えることがあり、この場合もエタノールを添加して保存する。
リ ジチゾンクロロホルム液(除鉛、定量用)
Dz5.0mgを精製クロロホルムに溶かして100mlとする。
使用の都度作る。
ヌ ジチゾンベンゼン
Dz2.0mgをベンゼン100mlに溶かす。
ル 鉛標準液
硝酸鉛(試薬特級)1.5984gを1%硝酸で1lとする。このもの1ml中には鉛1.0ml(1,000μg)を含有する。
これを使用前に1%硝酸で10μg/ml或いは1μg/mlとして用いる。
ヲ フエノールレツド(指示薬)
ワ チモール青(0.04%)
N/20水酸化ナトリウム液4.3mlをとり、微細粉末としたチモール青0.1gに少量ずつ加えて溶解し、これを精水約20mlで分液ロートに流し込み、次にアンモニア水を滴下しながらよく混合して、液が紫色を呈したら(pH9.0)、2%ジエチルジオカルバミン酸ナトリウム1lを加えてニと同様に処理して除鉛し、その後に精水を加えて250mlとする。しかし除鉛は実際上、いらない場合が多い。
3 検量曲線
鉛標準液を1%硝酸で、それぞれ1~50μgの鉛を含む溶液50mlずつを各濃度ごとに作り、これを分液ロートにとり、Dzクロロホルム溶液10ml、シアン化カリウム、アンモニア水混合液10mlを加てて直ちに強く振とうする。分層したクロロホルム層を比色計にかけて吸光度を知り検量曲線を作製する。
1例を示すと次のごとくである。
鉛(μ9) Dz量(ml) クロロホルム(ml)
1 0.1 9.9
5 0.5 9.5
10 1.0 9.0
15 1.5 8.5
20 2.0 8.0
25 2.5 7.5
30 3.0 7.0
35 3.5 6.5
40 4.0 6.0
45 4.5 5.5
50 5.5 5.0
4 試料の採取
(1) 血液 採取する血液量は10~20gとする。
(2) 尿 なるべく24時間尿から約100mlを定量用に供する。作業場で蓄尿するときには外部からの汚染をさけるように注意すること。
5 試料の前処理
(1) 乾式灰化法
イ 血液
血液をあらかじめ正確に秤量しておいた石英ビーカーに移し、すみやかに10mgの単位まで秤量する。ついで電熱板上で又は、赤外線ランプで100℃に加温し、完全に乾燥した後、電気炉に入れて除々に500℃とし、そのままで5~10時間加熱すれば、白色の灰をうる。
ロ 尿
蓄尿をよく混じて比量を測り、約100mlを石英ビーカーにとり、血液と同様に処理すれば白色の灰を得る。
(2) 湿式灰化法
イ 血液
採取秤量した血液をケルダールフラスコに入れ、硝酸15ml、硫酸3mlを加え除々に加熱して濃縮し、煙の色が黄褐色から黒色になつたとき止め、これを冷却して過塩素酸3mlを加える。再び加熱して煙が黒色から赤褐色になり、更に白煙をあげたところで止める。冷却して、精水20~30mlを加えて煮沸し、冷却して定量に供する。
ロ 尿
採取した尿を振りまぜ、比重を測り、その50~100mlを正確にはかつてケルダールフラスコに入れ、硫酸2mlを加え15~20mlまで煮沸濃縮し、硝酸15mlを加え、小火炎で徐々に加熱する。液が黄色透明となり、酸化窒素の褐色煙が発生するようになつたら一度冷却し、過塩素酸2mlを加え、さらに温度をあげる。三酸化イオウの白煙が発生し、液が微黄色又は殆んど無色になるまで加熱する。もし内容液が褐色をおびている場合には、さらに硝酸を追加し前と同様に小火炎で徐々に加熱して灰化をくり返す。
分解液に沈澱物があれば、石綿又はガラスろ過器を用いてろ過し、残留物は10~20ml精水をもつて洗い、ろ液に加える。
6 測定
(1) ジチゾン単色法
四塩化炭素を用いる方法もあるが、より簡便な方法としてベンゼン法(尿中鉛測定簡便法)をとりあげた。
イ 検液調製
灰化液に水15mlを加え、5~10分間煮沸後、クエン酸アンモニア液5mlを加え、常温まで冷却アンモニア水でアルカリ性(指示薬フエノールレツド)とし約5分間煮沸加温し、これを検液として分液ロートに移す。
ロ 抽出定量
検液(鉛1~100μg)に水を加えて約50mlとし、クエン酸アンモニア液5~10ml、チモール青指示薬2~3滴を加え、アンモニア水を滴下して青色を呈するまで中和する。塩酸ヒドロキシアルアミン溶液3mlを加え、アンモニア水を滴下して弱アルカリ性(pH約7.6)とする。Dzベンゼン10mlを正確に加え、約1分間ふりまぜ静置して分離する。
ベンゼン層が濃赤色を呈し、下層が殆んど無色あるいは徴かに橙色をおびるにとどまるときは、Dz量が不足していることをあらわすから、さらにDzベンゼンを正確に20ml加えて1分間振とうする。
下層を捨て、ベンゼン層にシアン化カリウム溶液Dzをベンゼン10mlについて40mlの割合で加え、約30秒間ふりまぜたのち下層を捨て、ベンゼン層を10mmのキユーペツトにとり、波長520mμで吸光度を測定する。
(2) ジチゾン混色法
イ 湿式灰化の場合は灰化液をそのまま定量に供する。乾式灰化物には塩酸2~5mlおよび精水約20mlを加えて、電熱板100°C以下に加温し、灰化物を完全に溶解させる。これにチモール青溶液数滴とクエン酸アンモニウム液15mlを加え、さらに塩酸ヒドロキシルアミン液1mlを加えアンモニア水で、pH8.5~9.0(淡青色)とする。この際、試料液のアンモニア液を加えすぎないこと。また白色沈澱物を生ずることがあるが、主として水酸化鉄燐酸塩であるから、クエン酸アンモニウム液を更に追加すると沈澱物が少量のときは溶解せしめうる。
ロ この試料液を分液ロート(a)に移し、石英ビーカーの内面を精水で数回洗い(a)に加える。
ハ (a)に10%シアン化カリウム5mlを加え、静かに混合したのち精製クロロホルム0.5mlとしDz液0.5ml加えて強く振とうする。静置すると分層したDzクロロホルム層は含有する鉛量に応じて、緑紫―エンジ―赤―朱紅の各段階の色調を示す。紫、エンジ、赤色の場合はDz液が不足であるので適当量のDz液を少量ずつ加えて振とうし帯紫濃エンジ色とする。
この時までに使用したDzの全量、Dzを最初0.5液加えた時の液の色調および最後の色調の三者を記録する。
ニ 次にこのものにDz1~3mlを追加、振とうし、静置して分層したDz―クロロホルム層を予め精水20mlを入れた第2の分液ロート(b)に分別する。(a)には少量の精製クロロホルムを加えて、なお(a)に残つている着色層を分別し(b)に加える。次に更に(a)に2~3mlDzを加え(a)内のDzの色調が原色のまま残るまで、数回追加、振とうして(b)への分別をくりかえす。
最後に(b)に少量の精製クロロホルムを加え残留する微量のDzを全て(b)に分別する。
ホ (b)を振とうして静置した後クロロホルム層の第3の分液ロート(c)に移し、少量の精製クロロホルムを数回にわたつて(b)に加えては振とうして(c)に分別し、(b)に加えた精製クロロホルムが着色しなくなるまでくりかえす。
ヘ (c)に1%硝酸50mlを加えて強く振とうすると、鉛はDzから離れて硝酸層に移行し、クロロホルム層はDzの原色である縁色にかえる。
そこでクロロホルム層を別の回収用容器に分別し(c)クロロホム層を数mlずつ加えて軽く振とうして、Dzを完全に分別し、(c)の活栓孔内に無色のクロロホルムが残る程度とする。
ト (c)に最初使用したDzと等量のDzを加える。Dzが少量すぎて色調判定と分別に不便と考えられるときは、適当量の精製クロロホルムを加える。次にシアン化カリウム、アンモニア水溶液10mlを加えて強く振とうする。クロロホルム層の色が赤色のときはDzの不足であるから、少量ずつDzを追加して振とうし、帯紫濃エンジ色になるまでくりかえす。(c)のクロロホルム層を10mlの目盛付共栓試験管に分別し、さらは(c)に少量の精製クロロホルムを加えて振とうし、この試験管に分別する。この操作を振とう後のクロロホルム層が呈色しなくなるまでくりかえす。最後に目盛付共栓試験管の10mlの目盛まで精製クロロホルムを加えてよく混ぜる。
共栓試験管の内容をキユーベツトに移し、波長510mμで吸光度を測定し、検量曲線から試料中の鉛量を知る。
(注) ブランクは血液又は尿の代りに、等量の精水を用い、毎日必ず実施する。
その大きさは1μg以下であるべきである。
附1 ポーラログラフ法
イ Dz混色法と同様にして得た酸性試料溶液に、チモーブルー数滴とクエン酸アンモニウム液5~10ml加え、アンモニア水でpH8.5~9.0とする。(この際白色沈澱物を生じたならばさらにクエン酸アンモニウム液を追加することにより溶解せしめうる。)
ロ この試料液を分液ロート(a)に移し、原容器に水で数回内部を洗つて(a)を加える。次に塩酸ヒドロキシルアミン液1mlを加え、アンモニア水でpH8.5~9.0調整し、更に10%シアン化カリウム5mlを加え混合する。その後これにDz液1mlを加え強く振とうする。静置により分層したDz層の色を記憶しておく。(後で1N塩酸を加えるときの参考とする。)
さらにDz液2mlを加え、強く振とう静置後Dz層を第2の分液ロート(b)に分別する。加えたDz液が振とう後も原色のままで残るまで(a)の振とう分別をくり返し、Dz層を(b)に加える。
ハ (b)に最初呈したDz層の色に応じて、1N―塩酸を加える。(Dz層が緑ないし帯緑紫のときは3ml、エンジないし朱紅のときは5ml程度のメスピペツトで、正確に加える。)強く振とうすることにより鉛はDzから離れて塩酸層に移行し、Dz層は原色たる緑色にかえる。しばらく放置した後Dz層は捨てる。
ニ ポーラロ用セルに分液ロートの上部より塩酸層を約2ml入れる。次にセルに水銀少量を入れ10~15分間窒素ガスを導入し、酸素を追い出す。
ホ (-)0.35V~(-)0.6V VS.S.CEの間で型のとおりにポーラログラフ操作を行なう。ここに1N―塩酸では鉛の半波電位は(-)4.3V VS.S.CEである。
原子吸光分析法による尿中および血中鉛量の測定法
原理:原子吸光分析は、原子が活性化される時に光を吸収する現象を利用した分析法である。金属元素は炎の中で熱解離して原子状態になるが、この状態が最も安定した電子配列を有する基底状態である。基底状態の原子にほかからのエネルギーを加えると、このエネルギーを吸収して励起状態になる。従つて原子蒸気を一定の温度で熱平衡を保たせておくと、一部は励起状態、他の一部は基底状態となる。特定の金属元素を炎に入れて原子蒸気とし、ほかから同じ元素のスペクトルを出す連続光を当てると、透過する連続光は吸収されて暗くなる。この吸収を利用したものが原子吸光(吸収)法である。
Ⅰ 尿中および血中鉛量のジチゾン抽出、原子吸光測定法
(1) 試薬
1) 硝酸
2) 硫酸
3) 過塩素酸
4) クエン酸アンモエア溶液
クエン酸50gを水に溶かし、アンモニアでアルカリ性とし(pH約9.5)、水を加えて全量を100mlとする、適当な濃度のジチゾンクロロホルムで鉛を除去したのち使用する。
5) 指示薬チモールブルー溶液
チモールブルーを少量のエチルアルコールに溶かし、さらに水を加えて溶液とする。溶液は0.04%位でよい。
6) アンモニア水
7) 5%シアン化カリウム溶液
水に100mlシアン化カリウム5gを溶かして作る。適当な濃度のジチゾンクロロホルムで鉛を除去したのち使用する。
8) 20%塩酸ヒドロキシルアミン溶液
塩酸ヒドロキシルアミン20gを水に溶かし、アンモニア水でアルカリ性とし、さらに水を加えて全量を100mlとする。適当な濃度のジチゾンクロロホルムで鉛を除去したのち使用する。
9) ジチゾンクロロホルム
ジチゾンクロロホルムは、分液ロート中でジチゾン100mgをクロロホルムに溶かし、水洗後、水を加えアンモニア水でアルカリ性にして振る。ジチゾンは水層に移る。水層をクロロホルムで洗浄し、クロロホルム層が淡緑色になるまでくり返す。水層を残し、水層を塩酸で酸性にし、クロロホルムを加えて振ると、ジチゾンはクロロホルムに移る。これを水洗して塩酸を除去して使用する。
10) 0.5%シアン化カリウム溶液
シアン化カリウム0.5gを水100mlに溶かして作る。適当な濃度のジチゾンクロロホルムで鉛を除去しておく。
11) 2%硝酸
硝酸2mlをとり、水で100mlとする。
12) 鉛基準液
硝酸鉛1.60gを精秤し、水に溶かし、硝酸(1+1)1mlを加えメスフラスコ1lに入れ、水で全量を1lとする。この溶液1mlを正しくメスフラスコ1lにとり、2%硝酸で標線までうすめる。この溶液は1ppm溶液である。同様にして各種ppmの鉛硝酸溶液を作成する。
注意事項:
イ 硝酸、硫酸、過塩素酸の鉛を除去することは大変である。従つて出来るだけ鉛の少ないものを使用しなければならない。鉛定量用のものでもかなり鉛を含んでいることがあるから注意すること。
ロ 試薬はすべて特級を使用すること。
ハ 鉛基準液は原子吸光測定のさい2%硝酸を用いるので、2%硝酸溶液としておく。
ニ 市販のジチゾンは、すでに酸化されているものを含んでいる場合もあるので、それを確認し、必要ならば純化しなければならない。
(2) 器具
1) ケールダールフラスコ
2) 分液ロート
3) 試験管(共栓試験管を含む)
4) ピペツト類、メスシリンダー、ビーカーなど一式
5) 湿式灰化のための熱源装置一式
6) 原子吸光分光光度計一式
注意事項:
(1) ケールダールフラスコ、分液ロート、試験管、ビーカーなどは超硬質ガラス(無鉛ガラス)製のものを使用すること。
(2) ガラス器具類はすべて10%硝酸を浸しておき、よく水洗したのち純水または鉛のない蒸留水で再水洗したのち使用する。
(3) 操作
1) 灰化
イ) 尿……尿100mlをケールダールフラスコにとり、硝酸20mlを加えて加熱する。酸化窒素の褐色の煙が殆んど出なくなり、液が淡黄色透明になればやめる(約2~3ml残してやめる)。冷却後過塩素酸3mlを加え加熱し、液が微黄色ないし無色に近くなるまで加熱する。この場合も加熱しすぎを防ぐことが大切で、約2ml残して加熱をやめる。
ロ) 血液……血液約10mlを予め秤量しておいたケールダールフラスコに入れ、再秤量し血液の重量を求めておいてから、硝酸20mlを加え加熱する。酸化窒素の煙が殆んど出なくなり、液が淡黄色透明となればやめる(約2~3ml残しておく)。次いで硫酸3mlを加え、色が殆んどなくなるまで加熱する(2~3ml残してやめる)。冷却後過塩素酸2mlを加えて微黄色ないし無色に近くなるまで加熱する。この場合も約2ml残して加熱をやめる、灰化のさい加熱しすぎると試料中の鉛が消失することがあるので、注意する必要がある。
2) 灰化液を純水または鉛のない蒸留水約50mlを用いて分液ロートへ移す。
3) 次いでクエン酸アンモエア溶液5mlを加える。
4) 指示薬チモールブルー溶液5~6滴加える。
5) アンモニア水でアルカリ性とする。鉛はpH8.5~11で抽出できるが、pH9.0~9.5位がよい。
6) 5%シアン化カリウム溶液5mlを加える。
7) 20%塩酸ヒドロキシルアミン溶液1mlを加える。
8) 5mlのジチゾンクロロホルムで2回抽出し、クロロホルムを試験管に合せておく、これで抽出を完了しない場合にはさらにこの操作をくり返す。抽出が終ればクロロホルムは緑色のままである(シアン化カリウムによつては緑色を消すことがあるので注意を要する)。抽出が終ってからジチゾンの入つていないクロロホルムを少量加えて振り、クロロホルムをさきの試験管に合せておく。
9) 試験管に集めたクロロホルムを分液ロートに移し、0.5%シアン化カリウム溶液20~30mlで軽く洗い、さちに20~30mlの水で軽く洗つてから、共栓付試験管に移し、2%硝酸100mlを加えて強く振る。このさい水層がクロロホルム層に入り込んでいると、水層はアルカリ性であるため、2%硝酸の酸度が落ち、鉛の硝酸への移行が悪くなる。従つて水層が少しもクロロホルム層に入らないように注意しなければならない。
10) 硝酸層の鉛濃度を原子吸光分光光度計によって測定する。共栓試験管を用いるさいにはその上層の硝酸層をそのまま噴霧して測定できる。
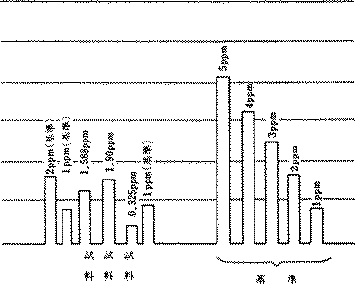
11) 基準としては1ppm(時には2ppm、3ppmなど)のるのを噴霧測定して、その波高を基準とする。1ppm、2ppm、3ppmなどの基準液で検量線を作成してもよい。(図1)
(図1)原子吸光分光光度計を用いた場合の基準液の高(1、2、3、4、5ppm)および実際の測定例(2%硝酸溶液)
注意事項:
(1) 本方法では尿中鉛量10μg/l、血中鉛量10μg/100g程度から測定可能である(実際には5μg程度から測定できる。尿の場合で本方法により測定できない場合には尿量を増やして測定し直すか、硝酸層を濃縮して測定すればよい。血液の場合も同様硝酸層を濃縮して測定することも可能であるが、鉛量が非常に少いことが予測され、この方法で測定不可能と考える場合(シチゾン抽出のさいにでも分るが)には、逆抽出の2%硝酸を5mlにすればよい。
(2) 本方法でジチゾシ抽出すれば、カドミウムはmaskingできないので(カドミウムはmaskingする方法はない)、原子吸光測定する硝酸には鉛とカドミウムが共存することになる。すなわちカドミウムと鉛を同時抽出することが可能であるということでもある。しかしカドミウムイオンは、鉛イオンによつて干渉され、測定値が高くなるので、カドミウムを測定する場合には別に抽出のさいのpHを12以上(pH13.5位の方がよい)にして、鉛をジチゾンとキレートさせずに単独に抽出した方がよい。反対に鉛のジチゾンによる単独抽出は不可能である。比色の場合にはジチゾン鉛も、ジチゾンカドミウムも最大吸収波長520mμ前後の赤(ピンク)色を呈するので、混合されて比色されていることになる。原子吸光測定の場合には鉛イオンは、尿中カドミウム量として10μg/l、血中カドミウム量として10μg/100g程度までのカドミウムイオンによつては干渉されないので、通常の場合にはカドミウムイオン存在は考慮に入れなくてよい。従つて原子吸光測定の方が比色法より正確な値をうることができる。
(3) 本方法はジチゾンクロロホルムを使用する混色法を採用した。ジチゾン抽出には四塩化炭素、ベンゼンを用いる単色法もあり、夫々長所をもつているが、数多くの検体をとり扱う場合の検査員の中毒の危険性を考えてクロロホルムを採用した。
(4) 本方法で最も重要なポイントはジチゾン抽出を完全にすること、硝酸へ移すさいに硝酸層へ水層を入れないことである。特に後者に注意すべきである。
(5) 希硝酸で逆抽出せずにクロロホルムや四塩化炭素、ベンゼンのまま測定する方法も考えられるが、クロロホルムや四塩化炭素はフレームが不安定であり、ベンゼンはフレームが非常に大きく白熱し、ススが出る(武内ら5)ので測定は感心しない。従つてジチゾン抽出のさいは、どの方法をとつても希硝酸に逆抽出して測定しなければならない。
(6) 測定にさいしてはその都度盲検値を測定しておかねばならない。また試薬の全ブランクは1μg以下であることが望ましく、そのようにすることは可能である。
(7) 原子吸光測定は僅かであるが経時変化する。またホロー・カソード、ランプは使用時間によつて感度が低下して来る。従つて基準はできるだけ頻繁に測定しておく必要がある。デジタル表示の原子吸光分光光度計を使用するさいにも終時変化とランプの感度低下に気をつけて対処しなければならない。また、検量線を使用する場合も、これらの点から再三・再四検量線を作成しなければならない。
Ⅱ 尿中および血中鉛量のAPDC―MIBK抽出、原子吸光測定法
A 尿中鉛の測定法
灰化して測定する方法
1 試薬
1) 硝酸
2) 硫酸
3) アンモニア水
4) 1%ピロリジン、ジチオカルバミン酸アンモニウム(APDC)溶液APDC1gを水100mlに溶かして作成する。要すればろ過する。
5) メチルイソブチルケトン(MIBK)
水を飽和させる。
6) 鉛基準液
硝酸鉛1.60gを精秤して水に溶かし、硝酸(1+1)1mlを加え、メスフラスコ1lに入れ水で全量を1lとする。この溶液1mlを正しくメスフラスコ1lにとり、水で殆んど標線までうすめ硝酸でpHを3.5注1)に合せてから、さらに水を標線まで加える。この溶液1mlは鉛0.001mgを含む(1ppm溶液)。
2 器具
1) ケールダールフラスコ
2) 分液ロート
3) 試験管
4) ピペツト類、メスシリンダー、ビーカーなど一式
5) 共栓付遠沈管(約50ml)
6) pHメーター
7) 遠心沈澱器
8) 湿式灰化のための熱源装置一式
9) 原子吸光分光光度計一式
10) 振盪機(できれば)
注意事項:―
ケールダールフラスコ、分液ロート、試験管、遠沈管などは超硬質ガラス(無鉛ガラス)製を使用すること。ガラス器具はすべて10%硝酸に浸しておきよく水洗したのち、純水または鉛のない蒸留水で再水洗して使用する。
3 操作
1) 灰化
尿50mlをケールダールフラスコにとり、硝酸、過塩素酸で湿式灰化する。灰化法はジチゾン抽出原子吸光測定の場合の灰化(Ⅰ、31)、イ)参照)と同様に行なう。
2) 灰化液を純水または鉛のない蒸留水約50mlで分液ロートに移し、アンモニア水でpHを3.5注1)にする。
3) 次いで1%ピロリジン・ジチオカルバミン酸アンモニウム(APDC)溶液3mlを加え数分振り、さらにメチルイソブチルケトン(MIBK)10mlを加えて数分振る。
4) 次に数分静置したのち共栓付遠沈管にMIBK層全部と水層の一部(入るだけ)を入れて遠沈したのち、MIBK層を噴霧測定する。注)
注) 出来るだけ早く測定すること。
5) 鉛基準液(1ppm)、10ml(pH3.5)を共栓付遠沈管に入れ1%APDC3ml、MIBK10mlを加え強く振り、水層とMIBK層が分離してから、MIBK層を噴霧測定したものが1ppmの基準波高である。この波高と試料の波高とを比べて鉛量を算定する。(図2)
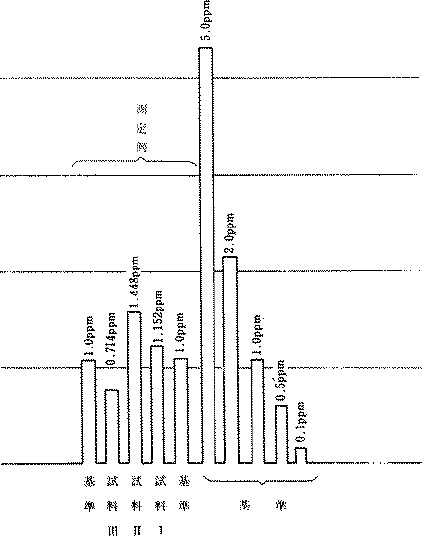
検量線を作成して算出する場合には鉛基準液5ml(0.5ppm)、10ml(1ppm)、15ml(1.5ppm)、20ml(2ppm)を同様共栓付遠沈管に入れ、夫々に1%APDC3ml、MIBK10mlを加えて振り、MIBK層を噴霧測定し、作成する。
(図2)原子吸光分光光度計を用いた場合のAPDC―MIBK法による基準波高と実際の測定例(MIBK10ml使用の場合)
注意事項:―
(1) 本方法で尿50ml使用する場合には尿中鉛量4μg/l程度のものから測定可能である。
(2) この方法においても盲検値は必ず測定しておかねばならない。
(3) 試薬ブランクはできるだけ少くしておく必要がある。
B 血中鉛量の測定法
灰化して測定する方法
1 試薬
1) 硝酸
2) 硫酸
3) 過塩素酸
4) アンモニア水
5) 1%ピロリジンジチオカルバミン酸アンモニウム(APDC)溶液
尿中鉛の灰化して測定する方法の項(Ⅱ、A、1、4)参照
6) メチルイソブチールケトン(MIBK)
尿中鉛の灰化して測定する方法の項(Ⅱ、A、1、5)参照
7) 鉛基準液
尿中鉛の灰化して測定する方法の項(Ⅱ、A、1、6)と同じ。
2 器具
1) ケールダールフラスコ
2) 分液ロート
3) 試験管、ピペツト類、メスシリンダー、ビーカーなど一式
4) 共栓付遠沈管(約50ml)
5) pHメーター
6) 遠心沈澱器
7) 湿式灰化のための熱源装置一式
8) 原子吸光分光光度計一式
9) 振盪器(出来れば)
注意事項:
ケールダールフラスコ、分液ロート、試験管、遠沈管などのガラスの質、洗浄のさいの注意は、ジチゾン抽出原子吸光測定の項(1、2の注意事項)参照
3 操作
1) 灰化
血液5~16ml(10ml使用の方がよい)とり、予め秤量しておいたケールダールフラスコに入れ、再秤量して血液の重量を測定しておく。次いで硝酸、硫酸、過塩素酸の順に湿式灰化する。灰化はジチゾン抽出原子吸光測定の項(Ⅰ、3、1)、ロ))の通りに行えばよい。
2) 灰化液を純水または鉛のない蒸留水約50mlで分液ロートに移し、アンモニア水でpHを3.5に合せる。
3) 1%APDC25mlを加えて数分振り、次いでMIBK10mlを加え数分振り、数分静置後、MIBK層と水層とが分離すれば、共栓遠沈管にMIBK層全部と入るだけの水層を入れて遠沈する。
4) 遠沈後MIBK層をできるだけ早く噴霧測定する。
5) 本方法では、血液中の鉄の存在か問題となるが1%APDC25mlを用いれば、影響が少ない。ただし、アルカリ性でトリエタノールアミンで鉄をいんぺいする方法もあるが、この場合は、ジチオカルバミンソーダを用いる。
6) 鉛の基準は尿中鉛の灰化して測定する方法の項(Ⅱ、A、1、6))と同じようにする。
注意事項:―
(1) 本方法では血液10ml使用した場合には、血中鉛量2μg/100g程度のものから測定できる。
(2) 測定にさいしてはその都度盲検値を測定しておくことが絶対必要である。
(3) 試薬ブランクはできるだけ少くすることが必要である。
(4) 基準は頻繁に測定しておかねばならない。検量線を使用する場合にも検量線を頻繁に作成しなければならない。またデジタル表示の器械を使用される場合には注意が必要である。
別紙(4)
CaNa2EDTA等キレート剤の使用による尿中鉛量の測定に関する認定上の取扱いについて
1.CaNa2EDTA等キレート剤の使用による尿中鉛量の測定について
(1) 鉛中毒の診断に当り、症例によっては、CaNa2EDTA等キレート剤を使用した後の尿中鉛量の測定(以下「いわゆる誘発法」という。)を行って、当該労働者の従前の鉛暴露の状態を確認あるいは推定し、その影響を検討するための参考に資することがある。
もともと、CaNa2EDTAは、鉛その他の重金属中毒の場合に、体内の重金属を置換して体外に排出することによって、当該中毒を治療するために用いられるものである。時によると副作用として、ショック、一過性の高血圧、腎障害、発疹等をひき起すおそれもあるので、いわゆる健康診断等の一方法として集団的に行なうことは避け、個々の症例について問題のある次のような場合であって医師が必要と認めたときに、充分に事前の諸検査(とくに腎機能の検査)をつくして行なわれるものである。
〔症例〕
現在は、鉛業務に従事していないが、過去に鉛業務に従事し、鉛暴露をうけたことのある労働者が、鉛中毒を強く疑わしめる症状を呈しているに拘わらず、尿中コプロポルフィリン、尿中デルタアミノレブリン酸、血中鉛、尿中鉛の検査ではさしたる所見は認められない場合。
(2) いわゆる誘発法は、普通はCaNa2EDTAの20mg/kg(体重1kg当り20mg)を5%ブドウ糖250ml/~500mlにとかし、1時間以上かけて徐々に点滴静脈注射して、注射開始から24時間の全尿を採尿し尿中鉛量を測定する方法が行なわれている。
なお、CaNa2EDTA錠の使用は、結果の画一性が期待できないところから原則として避けるべきものとされている。
2.いわゆる誘発法による場合の認定上の取扱いについて
いわゆる誘発法による結果、CaNa2EDTAを注射開始から24時間の全尿について、500マイクログラム以上の鉛が検出され、かつ、次に該当する場合には、労働基準法施行規則別表第1の2第4号の規定に基づく労働省告示第36号表中に掲げる鉛及びその化合物による疾病として取扱うこと。
前記1の(1)の〔症例〕に該当する事案であって、鉛の作用を疑わしめる末梢神経障害、腹部の疝痛等の症状が認められるか、又は血液検査の結果貧血が認められるものであること。